
|
Генетика человека изучает явления наследственности и изменчивости в популяциях человека, особенности наследования признаков в норме и изменения их под действием условий окружающей среды. Задачей медицинской (клинической) генетики является разработка методов диагностики, лечения и профилактики наследственных болезней человека.
Прогресс в развитии медицины приводит к относительному возрастанию доли генетически обусловленной патологии. К настоящему времени описано свыше 3500 наследственных болезней. Около 5-5,5% детей рождаются с наследственной или врожденной патологией. Половина спонтанных абортов обусловлена генетическими причинами. Не менее 30% перинатальной и нео-натальной смертности обусловлено врожденными пороками развития и наследственными болезнями с другими проявлениями.
С генетической точки зрения все болезни в зависимости от роли наследственных и средовых факторов в их развитии можно подразделить на 3 группы.
1. Наследственные болезни - фенотипическое проявление мутации как этиологического фактора практически не зависит от среды; последняя может только изменять выраженность симптомов и тяжесть течения болезни. Это генные и хромосомные наследственные болезни (гемофилия, фенилкетонурия, муко-висцидоз, болезнь Дауна и др.).
2. Болезни с наследственной предрасположенностью. Их в свою очередь можно подразделить еще на два вида. Болезни, наследственность при которых является этиологическим фактором, но для их проявления необходимо действие соответствующего фактора внешней среды (например, подагра, диабет).
Болезни, этиологическими факторами при которых являются средовые влияния, однако частота возникновения и тяжесть течения болезней зависят от наследственной предрасположенности. К таким болезням относятся атеросклероз, гипертоническая болезнь, язвенная болезнь, псориаз и др.
3. Болезни, в происхождении которых наследственность не играет роли. Это, например, травмы, ожоги, инфекционные болезни. Генетические факторы в этом случае могут влиять только на течение патологических процессов (скорость регенерации, выздоровления, компенсации функций).
Мутации как этиологический фактор. Этиологическими факторами наследственных болезней являются геномные, хромосомные и генные мутации.
Заболевания, обусловленные изменениями числа и структуры хромосом (геномные и хромосомные мутации соответственно), называются хромосомными болезнями. При хромосомных болезнях нарушается сбалансированность набора генов и наблюдаются отклонения от нормального развития организма. Это приводит к внутриутробной гибели эмбрионов и плодов, врожденным порокам развития и другим клиническим проявлениям. При хромосомных болезнях отклонения от нормального развития коррелируют, как правило, со степенью хромосомного дисбаланса. Чем больше хромосомного материала вовлечено в мутацию, тем раньше проявляется заболевание и тем значительнее нарушения в физическом и психическом развитии индивидуума. Избыток генетического материала проявляется, как правило, легче, чем его недостаток.
Заболевания, обусловленные изменениями структуры молекулы ДНК (генные мутации), называются генными болезнями.
Фенотипически генные мутации могут проявляться на молекулярном, клеточном, тканевом, органном и организменном уровнях. Генные мутации наследуются по законам Менделя.
Для наследственных болезней характерен клинический полиморфизм. Он обусловлен взаимодействием генетических и средо-вых факторов. Важное место в этом феномене занимают такие генетические явления, как генетическая гетерогенность организмов, пенетрантность и экспрессивность генов, явления плей-отропии и взаимодействие аллельных и неаллельных генов.
Термины "наследственные болезни" и "врожденные болезни" не являются синонимами, так как врожденные болезни (проявляющиеся с момента рождения) могут быть обусловлены как наследственными, так и средовыми тератогенными факторами (талидомид, сифилис, краснуха). В то же время не все наследственные болезни являются врожденными (вероятно, их около 50%). Некоторые болезни проявляются в детском (миопатия Дюшенна, гемофилия), другие - в зрелом (миотоническая ди-стония, хорея Гентингтона) и даже в пожилом (болезнь Альцгеймера) возрасте.
В основу генетической классификации наследственных болезней положен этиологический принцип: тип мутаций и характер взаимодействия со средой. Наследственные болезни подразделяются на 5 групп: генные болезни, хромосомные болезни, болезни с наследственной предрасположенностью (мультифакториальные), генетические болезни соматических клеток и болезни генетической несовместимости матери и плода.
Болезни с наследственной предрасположенностью могут быть моногенными и полигенными.
Генетические болезни соматических клеток выделены в самостоятельную группу наследственной патологии недавно. Они связаны с изменениями генетического материала соматических клеток, активирующими онкогены, вызывающими аутоиммунные процессы и др.
Болезни при несовместимости матери и плода по антигенам возникают в результате иммунологической реакции материнского организма на антигены плода. Наиболее хорошо изученным заболеванием этой группы является гемолитическая болезнь новорожденных, развивающаяся вследствие несовместимости матери и плода по Rh-антигенам. Эта группа составляет около 1% патологии новорожденных.
Особенности клинических проявлений наследственной патологии:
1. Наследственные заболевания часто носят семейный характер. В то же время наличие заболевания только у одного из членов родословной не исключает наследственного характера этой болезни (новая мутация, появление рецессивной гомозиготы).
2. Для наследственных заболеваний, проявляющихся в любом возрасте, характерно прогрессирующее хроническое течение.
3. При этих заболеваниях наблюдаются редко встречающиеся специфические симптомы или их сочетания: голубые склеры говорят о несовершенном остеогенезе, потемнение мочи на пеленках - об алкаптонурии, мышиный запах - о фенилкетонурии и др.
4. О наследственной причине заболевания свидетельствуют факты первичного вовлечения в патологический процесс многих органов или даже систем органов. Генетической основой этого явления служит плейотропное (множественное) действие гена. С клинико-генетической точки зрения различаются первичная и вторичная плейотропия. Первичная плейотропия обусловлена биохимическими механизмами действия мутантного белка. При фенилкетонурии нарушен обмен фенилаланина, который не превращается в тирозин. Недостаток тирозина ведет к снижению синтеза меланина, что выражается в гипопигментации кожи, волос и радужки. Вторичная плейотропия является следствием первичных патологических процессов. Муковисцидоз обусловлен заменой аминокислот трансмембранного белка, обеспечивающего ионный транспорт в клетках. Нарушение ионного транспорта Na+ и С1- ведет к формированию густой слизи в бронхах и в экзокринной части поджелудочной железы. Вследствие этого развиваются вторичные процессы легочных инфекций и нарушения'переваривания пищи.
5. Многие наследственные болезни носят врожденный характер. Не менее 25% всех форм генных наследственных болезней и практически все хромосомные болезни начинают формироваться уже внутриутробно.
6. Одним из признаков наследственной патологии является устойчивость к терапии, хотя в некоторых случаях лечение эффективно.
Общие принципы клинической диагностики наследственных болезней. Диагностика наследственной патологии является сложным и трудоемким процессом. Трудности обусловлены большим количеством нозологических форм (3500), разнообразием клинической картины каждой из них, наличием фенокопий, редкой встречаемостью некоторых форм. Врач общей практики не может владеть всем запасом знаний, необходимых для диагностики наследственных болезней, поэтому знание основных принципов диагностики этой патологии является целесообразным.
Клиническая диагностика наследственных болезней основывается На данных клинического, генеалогического и параклинического обследования.
Следует помнить, что наследственные болезни могут протекать сходно с ненаследственными. В некоторых случаях наследственная патология может сопутствовать основному, ненаследственному, заболеванию. Поэтому постановка диагноза должна быть двухэтапной:
1) общее клиническое обследование больного в соответствии с современными требованиями;
2) при подозрении на конкретную наследственную болезнь необходимо специализированное медико-генетическое обследование.
Общие клинические методы часто являются основными в диагностике наиболее известных и распространенных наследственных болезней (например, болезни Дауна). Полного клинического и параклинического обследования обычно достаточно для диагностики таких наследственных заболеваний, как ахонд-роплазия, нейрофиброматоз, хорея Гентингтона и др. Однако при этом возможны диагностические ошибки. Для их исключения, как правило, в дальнейшем необходимо проведение специальных генетических методов обследования (изучение кариоти-па, структуры молекулы ДНК и др.).
Особенности обследования больного с наследственной патологией. Вначале рассмотрим наиболее очевидные признаки наследственной патологии - врожденные пороки развития.
Под врожденными пороками развития понимаются стойкие морфологические изменения тканей или органов, выходящие за пределы вариаций их строения. Формирование врожденных пороков развития в результате нарушения нормального течения
эмбриогенеза называется тератогенезом (teras, teratos - урод, чудовище). Наука об этиологии, патогенезе и проявлениях врожденных пороков развития называется тератологией. Частота грубых врожденных пороков развития, сопровождающихся нарушением функций, в популяциях человека составляет 2-3%.
Формирование врожденных пороков - результат отклонений от нормального развития особи.
Единый процесс онтогенеза слагается из следующих этапов:
1) гаметогенез;
2) оплодотворение;
3) эмбриональный морфогенез;
4) постэмбриональное развитие.
В результате гаметогенеза образуются половые клетки, несущие в себе генетическую информацию, в процессе реализации которой из одной клетки (зиготы) развивается многоклеточный организм. При оплодотворении происходит объединение генетической информации материнского и отцовского организмов, что обусловливает комбинативную изменчивость.
Формирование морфологических структур эмбриона (эмбриональный морфогенез) включает эмбриональный гистогенез (возникновение специализированных тканей из малодифференцированных клеток эмбриональных зачатков) и органогенез (развитие органов и систем органов).
Эмбриональный морфогенез осуществляется при взаимодействии генотипа зародыша и организма матери и связан с процессами размножения, роста, дифференцировки, миграции и отмирания клеток. Эти процессы контролируются сложными взаимодействиями генетических, эпигеномных и внешних факторов, определяющих в конечном итоге временную и пространственную последовательность экспрессии (включения и выключения) блоков генов и тем самым дифференцировку клеток и морфогенез. Нарушение в процессе эмбриогенеза любого из вышеперечисленных механизмов вызывает отклонение от нормального развития, что может реализоваться во врожденном пороке.
На внутриклеточном уровне к "пусковым" механизмам нарушения развития относятся изменения молекулярных процессов репликации ДНК, биосинтеза белков-ферментов и др.
К основным клеточным механизмам тератогенеза относятся нарушения размножения, миграции и дифференцировки клеток. Результатом снижения митотической активности клеток могут быть гипоплазии или аплазии органа или его части. В результате нарушения миграции клеток могут развиваться гетеро-топии и другие пороки.
Дифференцировка, то есть образование разнородных клеток, тканей и органов из однородного эмбрионального зачатка, происходит последовательно в течение всего эмбриогенеза. Основной механизм специализации клеток - дифференциальная активность генов, в результате которой в разные фазы эмбриогенеза синтезируются специфические для каждой стадии ферменты, которые в основном и обеспечивают специализацию клеток. Если нарушается механизм включения и выключения отдельных блоков генов, это приводит к развитию различных пороков,
К основным механизмам тератогенеза на тканевом уровне относятся гибель отдельных клеточных масс, замедление распада и рассасывания клеток, отмирающих в ходе нормального эмбриогенеза, и нарушение адгезии тканей. Физиологическая гибель клеток происходит под действием лизосомальных ферментов в процессе окончательного формирования органов. Такая первичная гибель клеток наблюдается при слиянии нёбных отростков, открытии естественных отверстий, формировании пальцев. Задержка или замедление физиологического распада клеток могут приводить к синдактилии, атрезиям и другим порокам развития.
Так как пороки развития чрезвычайно многообразны, классификация их затруднена. Наиболее распространены классификации по этиологическому принципу и по локализации.
По этиологическому признаку различаются три группы пороков: наследственные, экзогенные и мультифакториальные.
К наследственным относятся пороки, возникшие в результате мутаций. В зависимости от вида изменений генетического материала наследственно обусловленные пороки подразделяются на генные и хромосомные.
В группу экзогенных объединяются пороки, обусловленные действием тератогенных факторов непосредственно на эмбрион или плод.
Пороки мультифакториальной (комбинированной) этиологии являются результатом совместного воздействия генетических и экзогенных факторов.
В настоящее время считается (Н.П. Бочков, 1997), что из общего числа врожденных пороков развития генетически обусловленные формы составляют 20-30%, мультифакториальные - 30-40%, экзогенные - 2-5%, неясной этиологии - 25-50%.
Условность приведенной этиологической классификации очевидна. Вместе с тем для медико-генетического прогноза важно знать, какой из факторов является ведущим (генетический или средовый).
По объекту воздействия тератогенных факторов врожденные пороки могут быть разделены на гаметопатии, бластопатии, эмбриопатии и фетопатии.
Гаметопатии - это наследственно обусловленные врожденные пороки, в основе которых лежат мутации в половых клетках родителей (например, синдром Дауна, обусловленный свободной трисомией; все врожденные пороки, обусловленные новой доминантной мутацией).
Бластопатиями называются поражения бластоцисты, то есть зародыша первых 15 дн после оплодотворения. Следствием бластопатий являются двойниковые пороки, циклопия и др.
Эмбриопатии - это врожденные пороки, возникшие в результате повреждения эмбриона (с 16-го дня после оплодотворения до конца 8-й недели). К последствиям эмбриопатий относятся диабетические, алкогольные, медикаментозные и многие другие пороки.
Фетопатии - это повреждения плода (от 9-й недели дб рождения). Пороки этой группы сравнительно редки. К ним можно отнести крипторхизм, гипоплазии и др.
По распространенности в организме врожденные пороки подразделяются на изолированные (одиночные), локализованные в одном органе (стеноз привратника), системные - в пределах одной системы органов (хондродисплазия) и множественные - в органах двух и более систем (сочетание расщелины губы, косолапости и порока сердца).
Наиболее распространена классификация изолированных врожденных пороков развития, основанная на анатомо-физиологических принципах деления тела человека на системы органов (пороки ЦНС и органов чувств, сердечно-сосудистой системы и т.д.). Множественные пороки чаще классифицируются по этиологическому принципу (хромосомные синдромы, генные синдромы, синдромы, обусловленные экзогенными факторами, и др.).
Важным этапом при обследовании больного с клинико-ге-нетической точки зрения является антропометрия. Для диагностики наследственных болезней важными оказываются следующие антропометрические данные: рост, масса тела, телосложение, пропорции тела, длина конечностей, длина туловища, окружность груди и черепа и др.
При осмотре пациентов наряду с выявлением врожденных пороков развития и проведением антропометрического обследования необходимо обращать внимание на микроаномалии развития, или врожденные морфогенетические варианты (отклонения в развитии, которые выходят за пределы нормальных вариаций, но не нарушают функции органа). Они являются неспецифическими показателями эмбрионального дисморфогенеза. Врожденные морфогенетические варианты встречаются у людей без какой-либо врожденной или наследственной патологии, но наличие более 5 таких признаков у одного индивидуума указывает на необходимость тщательного обследования его на предмет врожденной или наследственной патологии.
Наиболее распространенные признаки дисморфогенеза, учитываемые при дифференциальной диагностике наследственных болезней:
1) кожа: ангиомы, телеангиэктазии, пигментные пятна, веснушки темные (свыше 20), депигментация, гипертрихоз, гирсутизм, липомы, фибромы, келоидные рубцы, нарушение потоотделения, ихтиоз, повышенная растяжимость;
2) ногти: широкие, короткие, вогнутые; дистрофия, гипоплазия, аплазия;
3) волосы: сухие, редкие, шерстистые; алопеция (тотальная, гнездная), седая прядь надо лбом, "мыс вдовы", низкий рост волос на лбу и (или) на шее;
4) подкожная жировая клетчатка: избыточное отложение, уменьшенное количество, липомы;
5) мышцы: гипертрофия, гипотрофия, аплазия;
6) череп: микроцефалия, гидроцефалия, макроцефалия, брахицефалия, долихоцефалия, костные выступы или дефекты, выступающий лоб, плоский затылок;
7) ушные раковины: микротия, макротия, деформированные, низко расположенные, отклоненные назад, оттопыренные, завитки со сглаженным упрощенным рисунком, предушные фистулы, предушные папилломы;
8) область глаз и глаза: эпикант, страбизм (косоглазие), монголоидный разрез, антимонголоидный разрез, гипертелоризм, гипотелоризм, лелекант, колобома радужки, двойной или тройной ряд ресниц, миопия, гиперметропия, птоз, блефарофимоз, короткая глазная щель, гетерохромия радужек, синофриз, мик-рофтальм; экзофтальм, голубые склеры;
9) лицо: плоское, круглое, треугольное, вытянутое, с грубыми чертами;
10) нос: седловидная переносица, широкая плоская переносица, короткий нос, открытые вперед ноздри, плоские крылья носа, клювовидный нос;
11) губы и рот: фильтр (длинный, короткий, плоский, глубокий), тонкие, толстые губы; микростомия, макростомия, короткая уздечка языка, множественные уздечки губ, микро-глоссия, макроглоссия;
12) челюсти: прогения, ретрогения, микро- и макрогения, микро- и макрогнатия, диастема (верхняя, нижняя);
13) зубы: гипоплазия эмали, неправильная форма, неправильное расположение, врожденный избыток зубов, врожденное отсутствие одного или нескольких зубов;
14) нёбо: плоское, высокое, арковидное, готическое, расщепление язычка;
15) шея: короткая, длинная, кривошея, низкая линия роста волос, крыловидные складки;
16) грудная клетка и позвоночник: долихостеномелия, воронкообразная, килевидная, дополнительные соски, гипертелоризм сосков, сколиоз, кифоз, лордоз, пилонидальная ямка;
17) конечности и суставы: укороченные или удлиненные, X-или О-образные ноги, переразгибание суставов, полидактилия, олигодактилия, брахидактилия, арахнодактилия, клинодактилия, камптодактилия, синдактилия, широкий I палец, гипоплазия I пальца, укорочение отдельных пальцев, поперечная ладонная складка, сиднеевская складка, одна складка на V пальце, сандалевидная щель на стопе, плоскостопие, косолапость, полая стопа, конская стопа, стопа-качалка;
18) мочеполовая система: крипторхизм, гипоспадия, шалевидная мошонка, увеличенный клитор.
Существенным признаком, указывающим на наследственную или врожденную патологию, является нарушение течения беременности и пренатального развития плода (прерывание беременности, мало- и многоводие, несоответствие размеров и массы плода и новорожденного и др.).
Синдромологический подход к диагностике наследственных болезней. Известно, что в наследственной патологии не существует патогномоничных признаков. Чаще всего один и тот же признак встречается при многих заболеваниях, например аномалии почек - при 30, а искривление позвоночника - при 50 наследственных синдромах.
При внимательном осмотре больного врач может выявить признаки, существенно облегчающие дифференциальную диагностику. Например, запавшая переносица может быть признаком мукополисахаридоза и ахондроплазии; искривление нижних конечностей - следствием не только рахита, но и 25 различных наследственных болезней. Умственная отсталость - результат патологии при более чем 100 наследственных синдромах. Наследственные формы часто встречаются в практике окулистов. Атрофия зрительных нервов наблюдается при 15, катаракта и помутнение хрусталика - более чем при 30 наследственных болезнях.
Параклинические исследования играют существенную роль в диагностике наследственных болезней. Например, клинико-биохимические исследования проводятся при муковисцидозе, семейной гиперхолестеринемии, болезни Вильсона-Коновалова. Гематологические исследования позволяют подтвердить гемоглобинопатии, гемофилии. Эндокринологические исследования проводятся при врожденном гипотиреозе, адреногенитальном синдроме, нанизме. Электрофизиологические исследования позволяют установить различные виды миодистрофий и наследственную патологию нервной системы.
Методы изучения генетики человека. Изучение генетики человека связано с рядом особенностей и объективных трудностей:
1) сложный кариотип;
2) позднее половое созревание и редкая смена поколений;
3) малое количество потомков;
4) невозможность экспериментирования;
5) невозможность создания одинаковых условий жизни.
Для обследования больных и решения вопросов патогенеза наследственных заболеваний в медицинской генетике широко применяются общеклинические методы: электрокардиография,
электроэнцефалография, электромиография, биохимические анализы биологических жидкостей, биопсия тканей и др. Однако имеется целый ряд специфических методов, с помощью которых можно изучить вопросы возникновения, развития, распространения, механизмы передачи из поколения в поколение наследственных болезней и роль генотипа и факторов среды в их проявлении.
Клиникогенеалогический метод был предложен в 1883 г. Ф. Гальтоном. Он основан на построении родословных и прослеживании в ряду поколений передачи определенного признака. Этот метод относится к наиболее универсальным методам медицинской генетики. Он широко применяется для решения теоретических и прикладных проблем. Метод позволяет установить:
1) является ли данный признак наследственным (по проявлению его у родственников);
2) тип и характер наследования (доминантный или рецессивный, аутосомный или гоносомный);
3) зиготность лиц родословной (гомо- или гетерозиготы);
4) пенетрантность гена (частота его проявления);
5) вероятность рождения ребенка с наследственной патологией (генетический риск).
Этапы генеалогического анализа:
1) сбор данных обо всех родственниках обследуемого (анамнез);
2) построение родословной;
3) анализ родословной и выводы.
Обычно родословная собирается по одному или нескольким признакам. В зависимости от цели исследования родословная может быть полной или ограниченной. Желательно стремиться к наиболее полному составлению родословной по восходящему, нисходящему и боковым направлениям. Сложность сбора анамнеза заключается в том, что пробанд должен хорошо знать родственников по линии матери и отца не менее трех поколений и состояние их здоровья, что бывает крайне редко. Одного опроса, как правило, недостаточно. Для некоторых членов родословной приходится назначать полное клиническое, параклиническое или лабораторное обследование для уточнения состояния их здоровья. Подробное клинико-генеалогическое исследование проводится во всех случаях, когда при первичном клиническом осмотре возникает подозрение на наследственную болезнь.
Для построения родословных применяются условные обозначения. При построении родословной необходимо соблюдать следующие правила:
1) родословную начинают строить с пробанда;
2) каждое поколение нумеруется римскими цифрами слева;
3) символы, обозначающие особей одного поколения, располагаются на горизонтальной линии и нумеруются арабскими цифрами. Основой родословной является пробанд - лицо, с которого начинается исследование семьи. В родословных пробанд помечается знаком f.

Условные обозначения для построения родословных
Первая задача при анализе родословной - установление наследственного характера признака. Если в родословной встречается один и тот же признак (болезнь) несколько раз, то можно думать о его наследственной природе. После обнаружения наследственного характера признака (болезни) необходимо установить тип наследования. Для этого используются принципы генетического анализа и различные статистические методы обработки данных многих родословных.
Аутосомно-доминантный тип наследования характеризуется следующими признаками:
1) больные в каждом поколении;
2) больной ребенок у больных родителей;
3) болеют в равной степени мужчины и женщины;
4) проявление признака (болезни) наблюдается по вертикали и по горизонтали;
5) вероятность наследования 100% (если хотя бы один родитель гомозиготен), 75% (если оба родителя гетерозиготны) и 50% (если 'один родитель гетерозиготен).
Доминантно наследуемые болезни характеризуются полиморфизмом клинических проявлений и высокой вариабельностью сроков начала болезни. Для большинства болезней этого типа характерны такие патологические состояния, которые не наносят серьезного ущерба здоровью человека и в большинстве случаев не влияют на его способность иметь потомство. Так наследуются у человека полидактилия (шестипалость), веснушки, курчавые волосы, нейрофиброматоз , ахондроплазия, синдром Марфана и др. Следует подчеркнуть, что перечисленные признаки аутосомно-доминантного типа наследования будут проявляться только при полном доминировании. При неполном доминировании у потомков будет проявляться промежуточная форма наследования. При неполной пенетрантности гена больные могут быть не в каждом поколении.

Родословная с аутосомно-доминантным типом наследования
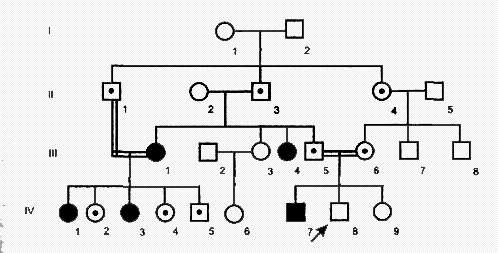
Родословная с аутосомно-рецессивным типом наследования
Аутосомно-рецессивный тип наследования характеризуется следующими признаками:
1) больные не в каждом поколении;
2) больной ребенок (гомозигота) рождается у здоровых родителей (гетерозигот);
3) болеют в равной степени мужчины и женщины;
4) проявление признака (болезни) наблюдается по горизонтали;
5) вероятность наследования 25% (если оба родителя гетерозиготны), 50% (если один родитель гетерозиготен, а второй гомозиготен по рецессивному признаку) и 100% (если оба родителя рецессивные гомозиготы). Чаще всего вероятность наследования болезни аутосомно-рецессивного типа составляет 25%, так как вследствие тяжести заболевания такие больные либо не доживают до детородного возраста, либо не вступают в брак. Так наследуются у человека фенилкетонурия, серповидно-клеточная анемия, муковисцидоз, галактоземия, болезнь Вильсона-Коновалова, адреногенитальный синдром, мукополисахаридозы и др.
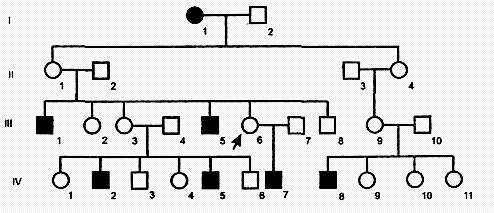
Родословная с Х-сцепленным рецессивным типом наследования
Х-сцепленный рецессивный тип наследования характеризуется следующими признаками:
1) больные появляются не в каждом поколении;
2) больной ребенок рождается у здоровых родителей;
3) болеют преимущественно мужчины;
4) проявление признака (болезни) наблюдается преимущественно по горизонтали;
5) вероятность наследования - у 25% всех детей, в том числе у 50% мальчиков;
6) здоровые мужчины не передают болезни. Так наследуются у человека гемофилия, дальтонизм, умственная отсталость с ломкой Х-хромосомой, мышечная дистрофия Дюшенна, синдром Леша-Найхана и др.
Х-сцепленный доминантный тип наследования сходен с аутосомно-доминантным, за исключением того, что мужчина передает этот признак только дочерям (сыновья получают от отца Y-хромосому). Примером такого заболевания является особая форма рахита, устойчивая к лечению витамином D.
Голандрический тип наследования характеризуется следующими признаками:
1) больные во всех поколениях;
2) болеют только мужчины;
3) у больного отца больны все его сыновья;
4) вероятность наследования у мальчиков 100%.
Так наследуются у человека некоторые формы ихтиоза, обволошенность наружных слуховых проходов и средних фаланг пальцев, некоторые формы синдактилии (перепонки между пальцами ног) и др.

Родословная с Х-сцепленным доминантным типом наследования

Родословная с голандрическим типом наследования
Близнецовый метод изучения генетики человека введен в медицинскую практику Ф. Гальтоном в 1876 г. Он позволяет определить роль генотипа и среды в проявлении признаков.
Различают моно- и дизиготных близнецов. Монозиготные (однояйцовые) близнецы развиваются из одной оплодотворенной яйцеклетки. Монозиготные близнецы имеют совершенно одинаковый генотип, но могут отличаться по фенотипу, что обусловлено воздействием факторов внешней среды. Дизиготные (двуяй-цовые) близнецы развиваются после оплодотворения сперматозоидами нескольких одновременно созревших яйцеклеток. Такие близнецы имеют разный генотип, и их фенотипические отличия обусловлены как генотипом, так и факторами внешней среды.
Монозиготные близнецы имеют большую степень сходства по признакам, которые определяются в основном генотипом.
Например, они всегда однополы, у них одинаковые группы крови по разным системам (ABO, Rh, MN и др.)> одинаковый цвет глаз, однотипные дерматоглифические узоры на пальцах и ладонях и др. Эти фенотипические признаки и используются в качестве критериев диагностики зиготности близнецов.
Процент сходства близнецов по изучаемому признаку называется конкордантностью, а процент различия - дискордант-ностью. Так как монозиготные близнецы имеют одинаковый генотип, то конкордантность у них выше, чем у дизиготных. Для оценки роли наследственности и среды в развитии того или иного признака используется формула Хольцингера:
КМБ(%) - КДБ(%) /100%-КДБ(%)
где Н - доля наследственности, КМБ - конкордантность монозиготных близнецов, КДБ - конкордантность дизиготных близнецов. Если результат расчетов по формуле Хольцингера приближается к единице, то основная роль в развитии признака принадлежит наследственности, и наоборот, чем ближе результат к нулю, тем больше роль средовых факторов.
Популяционно-статистический метод изучения генетики человека основан на использовании математического выражения закона Харди-Вейнберга, где р - частота встречаемости в популяции доминантного гена, q - частота встречаемости рецессивного гена, р2 - частота доминантных гомозигот, q2 - частота рецессивных гомозигот, a 2pq - частота гетерозигот. Сумма частот всех генотипов может быть принята за 1 (100%): р2 + 2pq + q2 = 1(100%). Метод позволяет определять частоту генов и генотипов в больших (свыше 4,5 тыс.) популяциях людей.
Цитогенетические методы. Цитогенетический метод основан на макроскопическом исследовании кариотипа. Этапы исследования:
1) культивирование клеток человека (чаще лимфоцитов) на искусственных питательных средах;
2) стимуляция митозов фитогемагглютинином (ФГА);
3) добавление колхицина (разрушает нити веретена деления) для остановки митоза на стадии метафазы;
4) обработка клеток гипотоническим раствором, вследствие чего хромосомы "рассыпаются" и лежат свободно;
5) простое и дифференциальное окрашивание хромосом;
6) изучение хромосом под микроскопом и фотографирование;
7) вырезание отдельных хромосом и построение идиограммы.
В 70-е годы прошлого века были разработаны методы дифференциального окрашивания хромосом человека, которые показали, что каждая пара хромосом имеет свой специфический характер чередования неокрашенных, светло- и темноокрашенных дисков (Парижская классификация). Метод позволяет выявлять геномные (например, болезнь Дауна) и хромосомные (например, синдром кошачьего крика) мутации. В таких случаях кариотип больного обозначают следующим образом: количество хромосом, набор гетерохромосом, номер хромосомы, короткого или длинного плеча и избыток (+) или нехватка (-) генетического материала. Например, болезнь Дауна у мальчика: 47,XY,21 + ; синдром кошачьего крика у девочки: 46,ХХ,5р-.
Молекулярно-цитогенетические методы основаны на флюоресцентной гибридизации in situ (FISH). Для исследуемой хромосомы или ее участка готовят однонитевой участок ДНК, к которому присоединяют биотин и дигоксигенин. Такой "помеченный" участок ДНК называется зондом. На микроскопическом препарате in situ денатурируют хромосомную ДНК (взятую у больного) щелочной обработкой, то есть разрывают связи между двумя цепочками ДНК. Препарат обрабатывают зондом. Так как последовательность нуклеотидов зонда и соответствующего участка исследуемой хромосомы комплементарны, то зонд присоединяется к хромосоме. В этом участке происходит ренатура.-ция ДНК. Далее препарат обрабатывают стрептовидином (вещество, избирательно присоединяющееся к биотину) и антиди-гоксигениновым антителом (избирательно присоединяется к ди-гоксигенину). К этим веществам присоединяют флюоресцентные красители (родамин - красный цвет или флюоресцеин - зеленый цвет). В люминесцентном микроскопе хорошо видны окрашенные хромосомы на фоне неокрашенных.
С помощью метода FISH можно определять локализацию генов в хромосомах и все хромосомные аберрации. В последнее время разработана методика применения этого метода для диагностики анеуплоидий в интерфазных ядрах.
Биохимические методы. Биохимические методы основаны на изучении активности ферментных систем либо по активности самого фермента, либо по количеству конечных продуктов реакции, катализируемой данным ферментом. Применяются хроматографические, флюорометрические, радиоиммунологические и некоторые другие методы. Они позволяют выявлять генные мутации - причины болезней обмена веществ (например, фенилкетонурии, серповидно-клеточной анемии). Они могут применяться и как экспресс-методы.
С помощью биохимических нагрузочных тестов можно выявлять гетерозиготных носителей патологических генов, например фенилкетонурии. Обследуемому человеку вводят внутривенно определенное количество аминокислоты фенилаланина и через равные промежутки времени определяют его концентрацию в крови. Если человек гомозиготен по доминантному гену (АА), то концентрация фенилаланина в крови довольно быстро возвращается к контрольному уровню (определяется до введения фенилаланина), а если он гетерозиготен (Аа), то снижение концентрации фенилаланина идет в два раза медленнее. Аналогично проводятся тесты, выявляющие предрасположенность к сахарному диабету, гипертонии и другим болезням.
Молекулярно-генетические методы. Эти методы позволяют анализировать фрагменты ДНК, находить и изолировать отдельные гены и их сегменты и устанавливать в них последовательность нуклеотидов.
Метод клонирования ДНК позволяет изолировать отдельные гены или их части, создавать неограниченное количество их копий, транскрибировать и транслировать изолированные гены, что стало возможным благодаря открытию ферментов-рестрик-таз. Эти ферменты "узнают" специфическую олигонуклеотидную последовательность в двухнитевой ДНК и разрезают ее в данном месте - сайте. Разные рестриктазы распознают различные последовательности нуклеотидов и разрезают ДНК в разных сайтах. В последние годы для получения достаточного количества фрагментов ДНК используется полимеразная цепная реакция - метод амплификации ДНК в условиях in vitro. В течение нескольких часов можно размножить ДНК в количестве, превышающем исходное в миллионы раз.
Методы гибридизации нуклеиновых кислот. После разрезания ДНК на фрагменты рестриктазами проводится их электрофорез на агарозном или полиакриламидном геле с целью разделения этих фрагментов. Далее осуществляется идентификация фрагментов ДНК.
Для выявления специфических фрагментов ДНК используется метод блот-гибридизации по Саузерну. Эта методика состоит из следующих этапов:
1) после окончания электрофореза гели помещают в щелочной раствор для денатурации фрагментов ДНК - получают одноцепочечные ДНК;
2) одноцепочечные ДНК вымывают из геля на нитроцеллюлозный или нейлоновый фильтры перпендикулярным поверхности геля током буфера; одноцепочечные фрагменты ДНК фиксируют на фильтре;
3) для визуального выявления нужных фрагментов проводят гибридизацию исследуемого образца со специфическим по нуклеотид-ной последовательности меченным радиоактивно или флюоресцентной меткой олигонуклеотидным синтетическим зондом; радиоактивно меченные участки выявляют путем экспонирования фильтра с рентгеновской пленкой (ауторадиография); флюоресцентные метки выявляют в люминесцентном микроскопе.
Этот метод позволяет обнаружить единственный ген среди десятков тысяч. Гомологичные последовательности можно идентифицировать как полностью, так и частично. Различные модификации этого метода позволяют в клинике анализировать очень малые количества ДНК, взятые у больного.
Для успешного применения в практическом здравоохранении молекулярно-генетических методов необходимо создание библиотек радиоактивных зондов всех последовательностей ДНК генома человека, и в этом направлении уже немало сделано.
Методы генетики соматических клеток. Наибольший интерес для генетики человека представляет метод гибридизации клеток. В 1960 г. французский ученый Ж. Барский, выращивая в культуре клетки двух линий мышей, обнаружил, что некоторые из них по своим морфологическим и биохимическим свойствам оказались промежуточными между исходными родительскими клетками. Это были гибридные клетки. Такое спонтанное слияние соматических клеток в культуре ткани происходит довольно редко. В дальнейшем было установлено, что при введении в культуру клеток РНК-содержащего вируса парагриппа Сендай, инактивированного ультрафиолетом, частота гибридизации клеток значительно повышается. В смешанной культуре разных типов клеток образуются гетерокарионы - клетки, содержащие два ядра разных клеток в одной цитоплазме. Часть таких клеток способна размножаться митозом. После митоза из двуядерного гетерокариона образуются две одноядерные клетки, каждая из которых представляет собой синкарион - настоящую гибридную клетку, содержащую хромосомы обеих родительских клеток, то есть происходит объединение двух геномов.
Гибридизация возможна между клетками не только организмов разных видов (человек - мышь), но и разных типов (человек - комар). Синкарионы обычно удается получать при гибридизации в пределах класса. Например, гибридные клетки человека и мыши имеют 43 пары хромосом: 23 - от человека и 20 - от мыши. В дальнейшем происходит постепенное удаление хромосом того организма, клетки которого имеют более медленный темп размножения. У гибридных клеток человека - мыши удаляются хромосомы человека.
В гибридных клетках функционируют хромосомы как человека, так и мыши, гены которых детерминируют синтез соответствующих белков. Морфологически можно отличить каждую из хромосом (дифференциальное окрашивание). Если в гибридной клетке отсутствует какая-либо хромосома и не происходит синтез каких-то белков, то можно предположить, что гены, детерминирующие синтез этих белков, локализованы в ней. Таким образом, этот метод позволяет устанавливать группы сцепления у человека, а используя нехватки и транслокации, - выяснять и последовательность расположения генов, то есть строить генетические карты хромосом человека.
Экспресс-методы - это быстрые предварительные методы изучения генетики человека. Они часто используются для исследования больших контингентов людей с целью выявления наследственной патологии как скрининг-методы, применяемые при проведении просеивающих программ. Например, скрининг новорожденных на фенилкетонурию, гипотиреоз, беременных
на альфа-фетопротеин, при помощи которого можно пренаталь-но определить у плода некоторые пороки развития (например, анэнцефалию, открытые формы спинномозговых грыж, синдром Дауна).
К этим методам предъявляются определенные требования:
1) метод должен быть диагностически значимым, то есть положительные и отрицательные результаты должны соответствовать наличию или отсутствию заболевания;
2) метод должен быть надежным: один и тот же образец при независимой двукратной проверке должен одинаково оцениваться;
3) исследованию должен подвергаться легкодоступный материал (кровь, моча) в малых количествах (например, пятна капиллярной крови, высушенной на фильтровальной бумаге);
4) метод должен быть приемлемым для обследуемых, исполнителей и врачей;
5) метод должен быть экономичным.
Микробиологический ингибиторный тест Гатри позволяет выявлять некоторые биохимические нарушения у новорожденных. Из пятки новорожденного берут кашпо крови на диски фильтровальной бумаги, которые помещают на агаровую культуру В. subtillis. Последнюю выращивают на минимальной питательной среде, содержащей антиметаболит искомой аминокислоты (например, фенилаланина). Антиметаболит должен одновременно тормозить рост микроба. При наличии в крови младенца большого количества фенилаланина антиметаболит разрушается и микробы начинают бурно расти. Меняя антиметаболиты, можно диагностировать наличие в крови определенных аминокислот и углеводов (лейцина, гистидина, фруктозы, галактозы и др.).
Биохимические и микробиологические экспресс-методы (флюорометрические, хроматографические, радиоиммунологические и др.) широко используются для быстрой предварительной диагностики наследственных болезней обмена веществ. Выявление Х- и Y-хроматина чаще осуществляется посредством соскоба клеток слизистой оболочки щеки (буквальный эпителий). Для выявления Х-хроматина мазки окрашивают ацеторсеином (или любой другой ядерной краской) и препараты просматривают в обычном световом микроскопе. Этот метод позволяет определить количество Х-хромосом в кариотипе по количеству телец Барра (их на одну больше, чем количество глыбок Х-хроматина).
Для выявления Y-хроматина мазки окрашивают 0,005% раствором акрихин-иприта и просматривают в люминесцентный микроскоп - Y-хромосома дает яркое зеленое свечение. Этот метод позволяет установить количество Y-хромосом в кариотипе.
Методы пренаталъной диагностики наследственных болезней. Пренатальная диагностика связана с решением ряда биологических и этических проблем до рождения ребенка, так как при этом речь идет не об излечении болезни, а о предупреждении рождения ребенка с патологией, не поддающейся лечению (обычно путем прерывания беременности с согласия женщины). При современном уровне развития пренатальной диагностики можно установить диагноз всех хромосомных болезней, большинства врожденных пороков развития, энзимопатий, при которых известен биохимический дефект. Часть из них можно установить практически в любом сроке беременности (хромосомные болезни), часть - после 12-й недели (редукционные пороки конечностей, атрезии, анэнцефалию), часть - только во второй половине беременности (пороки сердца, почек).
| Срок беременности (нед) | Методы и тесты |
| Первый визит (по возможностив самые ранние сроки) | Определение содержания гемоглобинаи гемато-крита крови. Общий анализ мочи, скрининг на инфекции мочевыхпутей Определение группы крови и Rh-фенотипа, титр анти-(Чп-антител урезус-отрицательных женщин. Титр антикраснушных антител Реакция ВассерманаЦитология мазка шейки матки Определение HBs-антигена в крови |
| 8- 18-я | Ультразвуковое исследованиеплода и плаценты Амниоцентез или биопсия хориона по показаниям |
| 16- 18-я | Уровень а-фетопротеина,а также хорион-гонадо-тропина и свободного эстриола в крови |
| 26- 28-я | Скрининг на сахарный диабет,повторное определение гемоглобина и гематокрита крови, анализ мочи набелок, сахар, нестрессовый тест |
| 28-я
| Повторное исследование титраанти-КИ-антител у резус-отрицательных беременных, профилактическое введениеанти-КН(0)-иммуноглобулина |
| 32- 36-я | УЗИ плода, определение гемоглобина,гематокрита крови, бактериологическое исследование вагинального мазка |
Показания для пренатальной диагностики: наличие в семье точно установленного наследственного заболевания; возраст матери старше 37 лет; носительство матерью гена Х-сцепленно-го рецессивного заболевания; наличие в анамнезе у беременных спонтанных абортов в ранние сроки беременности, мертворож-дений неясного генеза, детей с множественными пороками развития и с хромосомной патологией; наличие структурных перестроек хромосом (особенно транслокаций и инверсий) у одного из родителей; гетерозиготность обоих родителей по одной паре аллелей при патологии с аутосомно-рецессивным типом наследования; беременные из зоны повышенного радиационного фона.
В настоящее время применяются непрямые и прямые методы пренатальной диагностики. При непрямых методах обследуют беременную (акушерско-гинекологические методы, сыворотка крови на альфа-фетопротеин); при прямых - плод. К прямым неинвазивным (без хирургического вмешательства) методам относится ультрасонография; к прямым инвазивным (с нарушением целостности тканей) - хорионбиопсия, амниоцентез, кордоцентез и фетоскопия.
Ультрасонография (эхография) - это использование ультразвука для получения изображения плода и его оболочек, состояния плаценты. Начиная с 5-й недели беременности можно получить изображение оболочек эмбриона, а с 7-й недели - и его самого. К концу 6-й недели беременности можно зарегистрировать сердечную деятельность эмбриона. В первые два месяца беременности ультразвуковое исследование еще не позволяет выявить аномалии развития плода, но можно определить его жизнеспособность. Во 2-м триместре беременности возможности ультразвуковой диагностики значительно возрастают. На 12- 20-й неделе беременности уже возможна диагностика близнецовой беременности, локализации плаценты, анэнцефалии, дефектов костной системы и закрытия невральной трубки, атрезии желудочно-кишечного тракта.
По общему мнению, метод безопасен, поэтому продолжительность исследования не ограничена, и в случае необходимости его можно применять повторно. При физиологическом течении беременности целесообразно проводить двукратное УЗИ, а при беременности с высоким риском осложнений оно проводится повторно с интервалами в 2 нед. УЗИ плода обязательно при:
1) наличии у родителей и ближайших родственников врожденных пороков развития;
2) экстрагенитальных заболеваниях у беременной (гипертоническая болезнь, сахарный диабет, тиреотоксикоз, пороки сердца, ожирение и др.);
3) наличии мертворожденных детей, перинатальной смерти двух и более детей;
4) угрозе прерывания беременности, кровотечении;
5) недостаточной прибавке массы тела беременной;
6) несоответствии размеров матки сроку беременности;
7) многоплодии;
8) фибромиоме матки.
Ультразвуковое исследование позволяет получить данные о размерах плода (длина туловища, бедра, плеча, бипариеталь-ный диаметр головы), о наличии у него дисморфии, о функции миокарда, об объеме амниотической жидкости и размерах плаценты. УЗИ позволяет обнаружить у плода ряд аномалий развития - анэнцефалию, гидроцефалию, поликистоз или агенезию почек, дисплазию конечностей, гипоплазию легких, множественные врожденные пороки, пороки сердца, водянку (отек) плода и плаценты. Допплеровское ультразвуковое сканирование (а также цветная допплерометрия) отражает кровообращение в различных тканях плода.
Эхография плаценты позволяет установить ее расположение, наличие отслойки ее отдельных участков, кисты, кальцификаты (признак "старения" плаценты). Истончение или утолщение плаценты свидетельствует о вероятности фетоплацентарной недостаточности.
В последние годы получает распространение ЯМР-томогра-фия плода, позволяющая выявить структурные аномалии, не обнаруживаемые при УЗИ (малые аномалии мозга, туберозный склероз, поликистоз почек и др.).
Наиболее широкое распространение получила триада методов исследования: исследование уровня альфа-фетопротеина, содержания хорионического гонадотропина (ХГ) и свободного эстриола в крови женщин во 2-м триместре беременности. Содержание альфа-фетопротеина определяется также в амниоти-ческой жидкости, а свободный эстриол - в моче беременных. Отклонения плазматического уровня альфа-фетопротеина, хорионического гонадотропина, свободного эстриола у беремен-, ной служат индикаторами высокого риска для плода. Нормальные значения для определенных сроков гестации приводятся в табл. 104. Пороговыми (указывающими на высокий риск) считаются уровни альфа-фетопротеина и ХГ в крови беременной, превышающие 2МоМ (Multiple of Mediane), а для сниженного уровня альфа-фетопротеина при болезни Дауна пороговая величина менее 0,74 МоМ. Снижение уровня свободного эстриола, соответствующее значению 0,7 МоМ и ниже, также принимается как пороговое, свидетельствующее о фетоплацентарной недостаточности.
Значение МоМ для белка беременности I и белка, ассоциированного с беременностью А, при наличии у эмбриона болезни Дауна или трисомии 18 составляет 0,5-0,25 МоМ.
Концентрация альфа-фетопротеина определяется радиоиммунными методами. Альфа-фетопротеин обнаруживается в амниотической жидкости уже на 6-й неделе беременности (1,5 мкг/мл); наиболее высокая его концентрация наблюдается на 12-14-й неделе (около 30 мкг/мл); затем она резко снижается и на 20-й неделе составляет лишь 10 мкг/л. Хорошие результаты дает определение уровня альфа-фетопротеина в сыворотке крови матери. Его повышение обусловлено поступлением этого белка из сыворотки крови плода через плаценту при некоторых пороках развития.
| Компонент Сроки беременности | Медиана Колебания (Мой) |
| Альфа-фетопротеин, 10 -12нед | 2,4 1,0-5,0 |
| мг/100 мл 13- 14нед | 2,3 1,3-4,1 |
| 15- 16нед | 1,8 0,9-3,5 |
| 17- 18нед | 1,5 0,6-3,3 |
| 1 9-20 нед | 1,0 0,5-2,5 |
| 21-25 нед | 0,7 0,4-1,4 |
| 26 - 30 нед | 0,6 0,3-1,0 |
| 31-35 нед | 0,2 0,05-0,7 |
| 36 - 40 нед | 0,1 0,02-0,3 |
| Ацетилхолинэстераза,После 12-й нед 8,5 | |
| нанокатал, л | |
| Белок общий, г/л 1-я половина | 2,0-17,0 |
| . 2-я половина | 1,8-7,1 |
| Билирубин, общий, | |
| мг/л 1-я половина | 0,75 |
| мкмоль/л | 1,28 |
| мг/л 2-я половина | 0,25 |
| мкмоль/л | 0,43 |
| Гидрокортизон, нг/мл | 0,26 |
| мкмоль/л | 72,0 |
| Дегидроэпиандростерон, | - |
| нг/мл | 3,0-10,0 |
| мкмоль/л | 10,0-35,0 |
| 17-кетостероиды, | |
| нг/мл | 25,0-50,0 |
| нмоль/л | 10,0-35,0 |
| Крестинин, мг/100 мл 37нед | 2,0 |
| мкмоль/л | 177,0 |
| Лецитин | |
| дипальмитат, мкг/л 37 нед | 1000,0 |
| Лецитин/сфингомиепин 26- 30-я нед | Менее 1,0 |
| (отношение) 30 - 34-я нед | 1,0-1,5 |
| 34 - 35-я нед | 1,5-1,9 |
| 35 - 36-я нед | 2,0-2,2 |
| 37 - 40-я нед | 2,5-3,8 |
| 41 - 42-я нед | 3,8-5,2 |
| Эстриол свободный, 25-янед | 3,5-10,0 |
| мкг/л 28-я нед | 4,0-12,5 |
| 30-я нед | 4,5-14,0 |
| 32-я нед | 5,0-16,0 |
| 34-я нед | 5,5-18,5 |
| 36-я нед | 7,0-25,0 |
| 37-я нед | 8,0-28,0 |
| 38-я нед | 9,0-32,0 |
| 39-я нед | 10,0-34,0 |
| 40 - 41-я нед | 10,5-25,0 |
При скрининг-исследованиях высокое содержание альфа-фе-топротеина в крови выявляется у 2-4% женщин, его снижение - у 2,5% женщин во 2-м триместре беременности. Все беременные с измененным содержанием альфа-фетопротеина в крови нуждаются в дополнительном обследовании.
Содержание альфа-фетопротеина в биологических жидкостях повышено при множественных пороках развития, спинномозговой грыже, гидроцефалии, анэнцефалии, пороках развития желудочно-кишечного тракта и дефектах передней брюшной стенки, гидронефрозе и агенезии почек, а также при фетоплацентарной недостаточности, задержке внутриутробного развития плода, многоплодной беременности, преэклампсии, резус-конфликте и вирусном гепатите В. В случаях хромосомных болезней у плода (например, болезнь Дауна) или наличия у беременной сахарного диабета I типа, напротив, концентрация альфа-фетопротеина в крови беременных снижена. В настоящее время исследование альфа-фетопротеина проводится в 1-м триместре беременности одновременно с определением специфического для беременных белка А. Это позволяет диагностировать болезнь Дауна и некоторые другие хромосомные аномалии у плода уже на 11 - 13-й неделях гестации.
Хорионический гонадотропин, синтезируемый трофобластом плаценты, определяется уже на 8-9-й дни после зачатия. При исследовании крови женщины во 2-м триместре беременности повышение уровня ХГ и его свободных бета-субъединиц более 2 МоМ свидетельствует о задержке внутриутробного развития плода, высоком риске антенатальной гибели плода, отслойке плаценты или о других видах фетоплацентарной недостаточности.
Содержание свободного эстриола в крови беременной прогрессивно повышается за счет усиленного его синтеза плацентой из дегидроэпиандростерона, образуемого плодом, поэтому содержание свободного эстриола в биологических жидкостях (кровь, моча, амниотическая жидкость) отражает фетоплацен-тарную активность и снижается при патологии плода и нарушении функции плаценты.
Исследование уровня белка беременности I (Schwangerschaft protein I) в плазме крови женщин уже в 1-м триместре беременности может служить индикатором хромосомных болезней плода, при которых он снижается.
Хорионбиопсия - взятие эпителия ворсинок хориона для исследования - проводится трансцервикально (через канал шейки матки) или трансабдоминально под контролем ультра-сонографии между 8-й и 10-й неделями гестации. Полученная ткань используется для цитогенетических и биохимических исследований и анализа ДНК. С помощью этого метода можно выявлять все виды мутаций (генные, хромосомные и геномные). Значительным преимуществом биопсии ворсин хориона является то, что этот метод пренатальной диагностики может быть использован уже на ранних этапах развития плода. Если выявляются какие-либо отклонения в развитии плода и родители решают прервать беременность, то прерывание беременности на 12-й неделе (срок проведения биопсии ворсин хориона) менее опасно, чем на 18-20-й неделе, когда становятся известны результаты амниоцентеза.
Амниоцентез - получение амниотической жидкости и клеток плода для последующего анализа. Это исследование стало возможным после того, как была разработана технология трансабдоминального или трансвагинального амниоцентеза, проводимого под контролем УЗИ. Получение исследуемого материала (клетки и жидкость) возможно на 16-й неделе беременности. Основные показания для амниоцентеза:
общие:
1) возраст беременной более 35 лет;
2) превышение пороговых значений уровней альфа-фетопротеина, хорионичеокого гонадотропина и снижение свободного эстриола в крови беременной:
3) наличие нескольких серьезных факторов риска осложнений беременности;
отдельные:
1) мертворождения, перинатальная смертность в акушерском анамнезе;
2) рождение предыдущего ребенка с хромосомными болезнями или с дисморфическими признаками;
3) хромосомный сбалансированный мозаицизм у родителей;
4) синдром ломкой Х-хромосомы у ближайших родственников;
5) определение пола плода при риске наследственных Х-сцепленных заболеваний (гемофилия, иммунодефицит и др.);
6) диагностика наследственных болезней обмена веществ;
7) воздействие тератогенных агентов на организм беременной в критические периоды эмбриогенеза;
8) задержка внутриутробного развития и дисморфия плода по данным УЗИ;
9) риск внутриутробных инфекций (краснуха, цитомегалия, токсоплазмоз).
Осложнения при этом методе исследования не превышают 1%.
Амниотическая жидкость используется для биохимических исследований (выявляются генные мутации), а клетки - для анализа ДНК (выявляются генные мутации), цитогенетическо-го анализа и выявления Х- и Y-хроматина (диагностируются геномные и хромосомные мутации). Простые биохимические исследования амниотической жидкости могут дать ценную диагностическую информацию - исследования содержания билирубина, эстриола, креатинина, кортизола, 17-оксипрогестерона, соотношения содержания лецитина и сфингомиелина. Диагностика адреногенитального синдрома у эмбриона (недостаточность 21-гидроксилазы) возможна уже на 8-й неделе гестации, когда в амниотической жидкости обнаруживается повышенное содержание 17-гидроксипрогестерона.
Исследование спектра аминокислот амниотической жидкости позволяет выявить некоторые наследственные болезни обмена веществ у плода (аргинин-янтарную ацидурию, цитрулли-нурию и др.), а определение спектра органических кислот используется для диагностики органических ацидурий (пропионовая, метилмалоновая, изовалериановая ацидурия и др.).
Для распознавания тяжести гемолитической болезни у плода при резус-сенсибилизации беременной производится прямое спект-рофотометрическое исследование амниотической жидкости.
Исследование клеток амниона в культуре применяется для выявления хромосомных аберраций или определения активности ферментов.
Кордоцентез - взятие крови из пуповины, клетки и сыворотка которой используются для цитогенетических, молекуляр-но-генетических и биохимических исследований. Эта процедура проводится в срок с 18-й по 22-ю неделю беременности под контролем УЗ И. Кордоцентез может быть осуществлен также при проведении эмбриофетоскопии. Процедура успешна с первой попытки в 80-97% случаев. Преимущество кордоцентеза по сравнению с амниоцентезом заключается в том, что лимфоциты культивируются значительно быстрее и надежнее, чем амнио-циты. Например, определение вирусоспецифической ДНК или РНК (методом обратной транскрипции) в крови плода имеет решающее значение для диагностики внутриутробных инфекций - ВИЧ, краснухи, цитомегалии, парвовируса В19. Однако показания для проведения кордоцентеза ограничены в связи с высоким риском осложнений, таких как внутриутробная гибель плода (до 6%), недонашивание беременности (9%).
Фетоскопия - осмотр плода фиброоптическим эндоскопом, введенным в амниотическую полость через переднюю стенку матки. Метод позволяет осмотреть плод, пуповину, плаценту и произвести биопсию. Фетоскопия сопровождается высоким риском прерывания беременности и технически сложна, поэтому имеет ограниченное применение.
Современные технологии позволяют осуществлять биопсию кожи, мышц, печени плода для диагностики генодерматозов, мышечных дистрофий, гликогенозов и других тяжелых наследственных заболеваний. Риск прерывания беременности при применении инвазивных методов пренатальной диагностики составляет 1-2%.
Везикоцентез, или пункция мочевого пузыря плода, используется для получения его мочи для исследования в случаях серьезных заболеваний и пороков развития органов мочевой системы.
Доимплантационная диагностика серьезных наследственных болезней стала возможной в последнее десятилетие благодаря разработке технологии экстракорпорального оплодотворения и использования полимеразной цепной реакции для получения множественных копий эмбриональной ДНК. На стадии дробления оплодотворенной яйцеклетки (бластоцисты), когда зародыш состоит из 6-8 отдельных клеток, методами микроманипуляции отделяется одна из них для выделения ДНК, ее мультипликации и последующего анализа с помощью ДНК-зондов (прай-мерная полимеразная цепная реакция, Sauthern-blot, исследование полиморфизма рестрикционных фрагментов ДНК и др.). Эта технология применена для выявления наследственных болезней - Тея-Сакса, гемофилии, миодистрофии Дюшенна, фрагильной Х-хромосомы и ряда других. Однако она доступна немногим крупным центрам и отличается очень высокой стоимостью исследования.
Разрабатываются методы выделения клеток плода (эритро-бластов, трофобластов и др.), циркулирующих в крови беременной, для проведения цитогенетических, молекулярно-генетических и иммунологических анализов в диагностических целях. Пока такая диагностика возможна лишь в тех случаях, когда в клетках крови (эритробластах) беременной имеются хромосомы или гены плода, например Y-хромосома, ген резус-фактора у резус-отрицательной женщины, антигены системы HLA, унаследованные от отца.
Дальнейшее развитие и распространение методов пренаталь-ной диагностики наследственных заболеваний позволят значительно снизить частоту наследственной патологии новорожденных.
| Главная страница |
|